El Cecmed se caracteriza por la preparación y el compromiso de sus trabajadores. Autor: Abel Rojas Barallobre Publicado: 31/07/2021 | 09:45 pm
Un frasco de jarabe, un equipo de ultrasonido o de rayos X, un test diagnóstico, una tableta de loratadina… Detrás de cada medicamento que se vende en las farmacias y de cada equipo o dispositivo que garantiza los servicios en el sector de nuestra salud encontramos al Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), autoridad reguladora encargada de avalar su calidad, seguridad y eficacia desde que comienza el proceso de fabricación.
Desde 1989 este centro —el primero en América Latina en ser certificado por la Organización Mundial de la Salud (OMS) como competente para el sistema de regulación de vacunas, desde el año 2000— protege la salud pública y, sobre todo, a cada uno de nosotros, al garantizar el acceso oportuno al mercado de productos seguros, cumpliendo con las normas establecidas por la OMS y la Organización Panamericana de la Salud (OPS).
También tiene el encargo de supervisar lo relacionado con las funciones básicas de certificación de cumplimiento de buenas prácticas, liberación de lotes de productos biológicos, registro de medicamentos, diagnosticadores, equipos y dispositivos médicos, ensayos clínicos, vigilancia poscomercialización e inspección de buenas prácticas, entre otras.
La máster en Ciencias Olga Lidia Jacobo Casanueva, directora del Cecmed, dijo que en 2011 este amplió su alcance al fusionarse con el Centro de Control Estatal de Equipos Médicos. Fue en 2010, afirmó, cuando el centro fue certificado por la Organización Panamericana de la Salud (OPS), en otro proceso riguroso de inspección, y calificado como Autoridad de Referencia en la Región de las Américas.
Con semejante prestigio internacional y gracias a la preparación y el compromiso de sus trabajadores, la institución no ha cesado su trabajo habitual, incluso en el contexto de la actual situación sanitaria, que le ha impuesto ritmos y retos cada vez mayores, en función de acompañar a los candidatos vacunales en sus diferentes fases y a todos los medicamentos y equipos empleados en el enfrentamiento a la COVID-19.
Con rigor y en menos tiempo

El proceso de registro de vacunas implica mayor rigor que el de otros medicamentos, asevera Olga Lidia Jacobo Casanueva, directora del Cecmed. Foto: Abel Padrón Padilla/ Cubadebate.
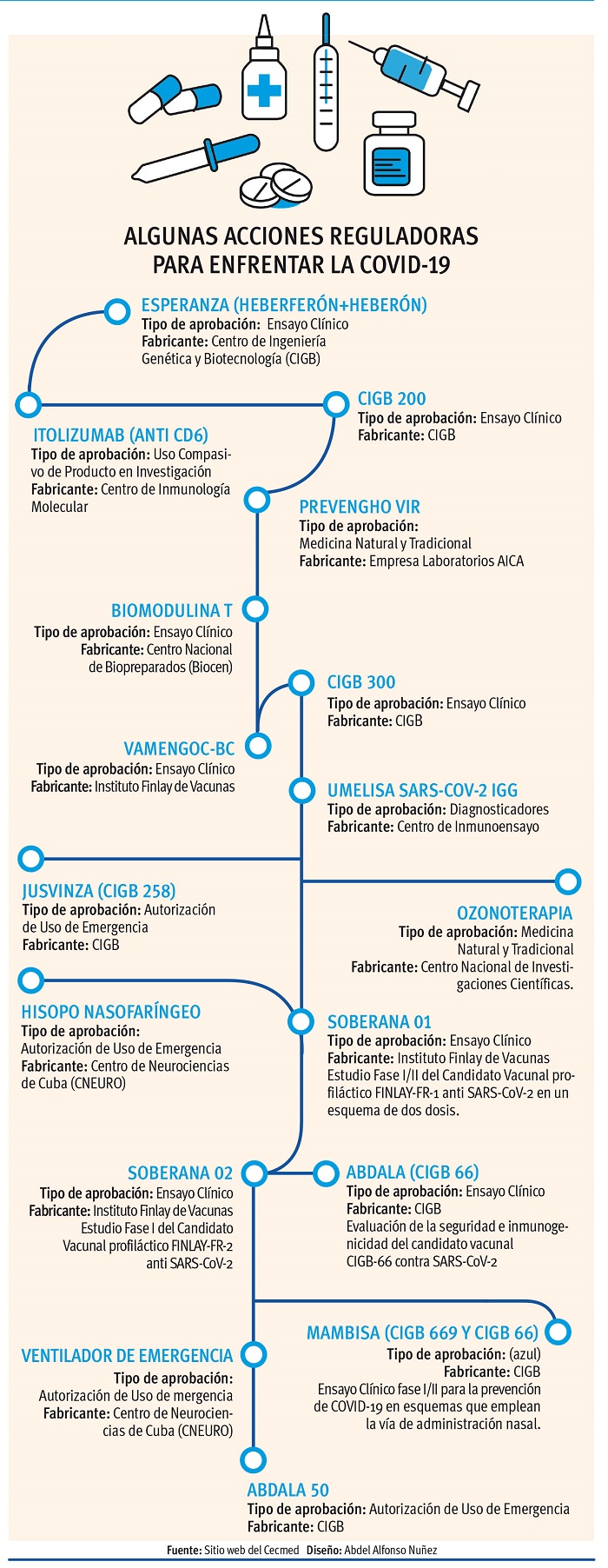
Durante la pandemia el Cecmed ha realizado acciones reguladoras para garantizar los suministros y la vitalidad del Sistema Nacional de Salud, y se han emitido documentos normativos y reguladores encaminados a garantizar el funcionamiento del centro y facilitar la evaluación de productos para la salud destinados al enfrentamiento al SARS-CoV-2.
Así lo afirmó la licenciada en Ciencias Farmacéuticas Danay Mora Pascual, subdirectora que atiende las áreas técnicas (Departamento de Medicamentos y Biológicos, de Inspección y Vigilancia y Equipos y Dispositivos Médicos), quien refirió que en estos tiempos el reto mayor que afrontaron fue el de acortar los plazos de evaluación.
«Priorizamos los productos relacionados con la COVID-19, sin violar los pasos elementales y el rigor que amerita cada proceso. Habitualmente tenemos hasta 90 días para emitir los dictámenes finales, pero ahora lo hacemos en menos de 30 días».
Al referirse al tema de los candidatos vacunales detalló que el Cecmed es la entidad nacional responsable de dar la aprobación para su uso masivo en el país, según la vía regulatoria establecida, que será la emisión de un Autorizo de Uso de Emergencia, y es vital supervisar cada etapa del proceso para velar por la seguridad y la calidad de estos productos.
A la par de las prioridades que impone la COVID-19, el centro continúa el trabajo de evaluación para los productos destinados al Sistema Nacional de Salud, como los antibióticos, afirmó Mora Pascual, quien insistió en que además se mantiene el apoyo a los procesos acelerados para acortar los tiempos y se les da seguimiento a todas las actividades que estamos desarrollando.
Monitorear todas las actividades

Para Mario César Muñiz Ferrer, jefe del Departamento de Equipos y Dispositivos Médicos, es fundamental lograr supervisiones de rigor.Foto:Abel Rojas Barallobre.
Mario César Muñiz Ferrer, jefe del Departamento de Equipos y Dispositivos Médicos de la institución, comentó que se mantuvo el trabajo de elaboración de disposiciones reguladoras, la agilización de las evaluaciones/autorizaciones de dispositivos médicos, la adecuación del sistema de auditorías reguladoras y el fortalecimiento del sistema de vigilancia posmercado.
«Además se ha trabajado de conjunto con la OPS/OMS en el desarrollo de la Herramienta Global de Evaluación de Autoridades Reguladoras, con la Inclusión de Equipos y Dispositivos Médicos. Nuestra razón de ser, desde antes de la aparición de la COVID-19, es supervisar que cada equipo o dispositivo para su uso en el sector debe cumplir con los parámetros establecidos».
Muñiz Ferrer reveló que más del 70 por ciento de los dispositivos médicos son importados, principalmente de China, y que debido a ese convenio se emplean más de 20 000 renglones de material gastable en el Sistema Nacional de Salud.
Agregó que los especialistas han participado en la elaboración de las instrucciones que establecen los requisitos para el desarrollo y la producción de equipos médicos, como las evidencias que es necesario presentar para las Autorizaciones de Uso en Emergencia de dichos equipos.
«Se establecieron equipos multidisciplinarios para el acompañamiento, asesoría reguladora y la evaluación por etapas de los desarrollos nacionales, con la incorporación de expertos externos a los mismos. Se realizó una búsqueda de las normas relacionadas.
«Se coordinaron los ensayos técnicos y preclínicos necesarios y sobre qué bases había que realizarlos para demostrar la eficacia y seguridad de los equipos y dispositivos en desarrollo, contando con la presencia de evaluadores del Cecmed en dichos ensayos, a fin de avalarlos.
«Igualmente, se realizaron visitas técnicas a los sitios de producción con el objetivo de hacer los señalamientos oportunos acerca de los aspectos que pueden conspirar contra la calidad de los productos, y se participó en la evaluación de las evidencias presentadas por los fabricantes», apuntó.
Expresó que se pospusieron las auditorías reguladoras como requisito de los procesos de inscripción de fabricantes y se priorizó el análisis de las evidencias documentales. «Entre las auditorías a fabricantes nacionales se destacan las del Sistema de Gestión de la Calidad para el diseño y fabricación de ventiladores pulmonares y el kit para exudado nasofaríngeo y transporte de muestras».
No faltan las evaluaciones

El centro continúa el trabajo de evaluación para los productos destinados al Sistema Nacional de Salud, dijo Danay Mora Pascual, subdirectora del Cecmed.Foto:Abel Rojas Barallobre.
Entidades de la industria nacional trabajan en el desarrollo de cinco proyectos de ventiladores pulmonares. Hasta el momento solo uno ha sido aprobado luego de todo el protocolo establecido, y en ello también ha tomado parte el Cecmed, puntualizó Muñiz Ferrer.
«Hemos brindado asesoría reguladora y acompañamiento, que incluye diseminación de normas afines, elaboración de las instrucciones que establecen los requisitos para la producción de ventiladores emergentes, así como las evidencias para presentar, evaluación de protocolos de ensayo, participación como observador en los ensayos y pruebas realizadas y liberación de lotes.
«Entre los próximos pasos que debemos seguir está la evaluación de la evidencia resultante del uso clínico de los dispositivos autorizados para la emisión del registro sanitario de los mismos», detalló el Jefe del departamento de Equipos y Dispositivos Médicos de la institución.
En pandemia, precisó, se extendió la validez de las autorizaciones vigentes y se aplazó la mayoría de las inspecciones reguladoras para el otorgamiento de licencias y certificaciones de buenas prácticas, y se priorizaron las revisiones documentales, pero realizando solamente las imprescindibles.
«También se ha brindado asesoría reguladora a compañías extranjeras, agilizando el Registro Sanitario de sus productos, así como la revisión y aprobación de lotes de los productos para la detección de anticuerpos al SARS-CoV-2, con vistas a su liberación.
«Se produjo un incremento de las solicitudes de Autorizaciones Excepcionales, motivado por las dificultades logísticas, que afectaron los aseguramientos, principalmente de material de envase, y se han incorporado 15 nuevas entidades al Sistema de Vigilancia poscomercialización de la Autoridad Reguladora», detalló.
¿Qué es la autorización del uso de emergencia?
La máster en Ciencias Olga Lidia Jacobo Casanueva, directora del Cecmed, precisó que el autorizo o autorización para el uso de emergencia se hace con el objetivo de amparar el uso de medicamentos, incluidas las vacunas, equipos y dispositivos médicos que sirvan para tratar, prevenir o diagnosticar enfermedades que pongan en peligro la vida, cuando no existen otras alternativas aprobadas y cuando se hayan cumplido ciertos criterios regulatorios que permitan minimizar el impacto del SARS-CoV-2.
Ese estatus regulatorio permite el uso masivo del inmunógeno —oficialmente como vacuna— en el territorio nacional y su comercialización a otras naciones mientras se mantenga la emergencia sanitaria, precisó, y enfatizó en que aún se trabaja hacia la obtención del Registro Sanitario definitivo.
Esa autorización de uso de emergencia es requerida para todas las vacunas empleadas en el mundo contra la COVID-19, añadió. «Se solicita al Cedmed el registro sanitario una vez concluida la fase III de ensayos clínicos y cuando se obtengan todos los datos referidos a la seguridad, eventos adversos y respuesta inmune, entre otros aspectos de vital interés.
«El proceso de registro de vacunas implica mayor rigor que el de otros medicamentos, por ello nuestra institución verifica la documentación y todo el proceso relacionado con la vacunación».
Especificó Jacobo Casanueva que teniendo la autorización de uso de emergencia se puede solicitar a la Organización Mundial de la Salud el proceso de revisión de una vacuna, con lo que se facilita el acceso de esta a otros países y se incluye en un listado de vacunas recomendadas por ese organismo.


 20
20





